Czym są kannabinoidy?
Kannabinoidy są związkami chemicznymi nazywanymi terpenofenolami, które są produkowane w gruczołach roślinnych, zwanych trichomami. Znajdują się one jedynie na kwiatach żeńskich. Do tej pory stwierdzono ich ponad 100 rodzajów[1].
W roślinach naturalnie występują w postaci kwasów, które również wykazują działanie biologiczne, jednak aktywne formy uzyskuje się podczas procesu dekarboksylacji.
Głównymi i dominującymi fitokannabionoidami są – kwas tetrahydrokannabinolowy (THCa), kwas kannabidiolowy (CBDa), kwas kannabinolowy (CBNa), kwas kannabidiwarinowy (CBDVa) oraz kwas cannabichromenowy (CBCa).
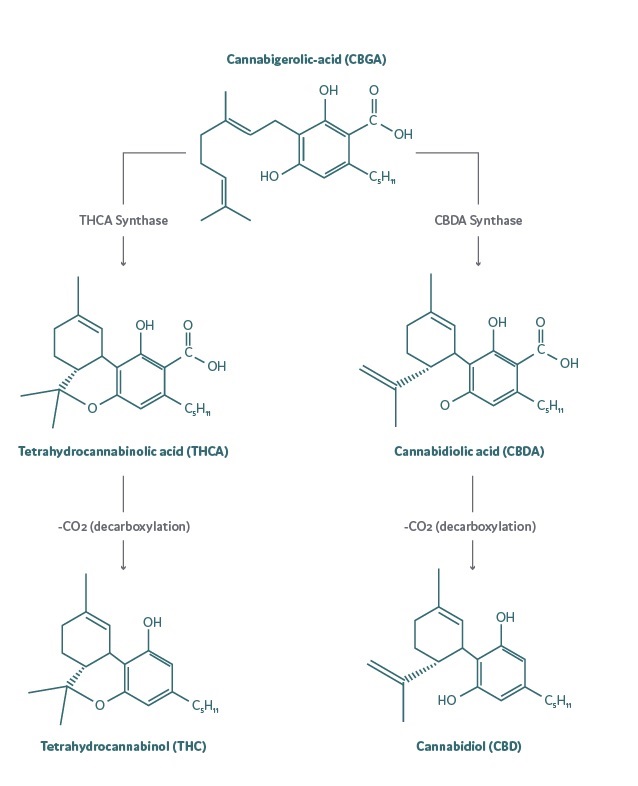
Rys. Proces syntezy i dekarboksylacji THCa i CBDa do kolejno THC i CBD.
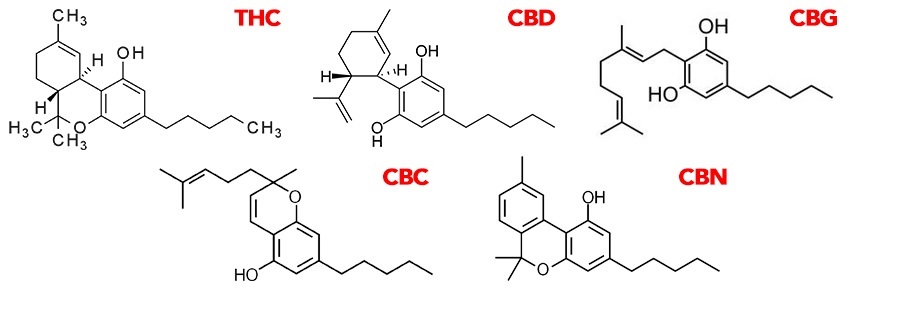
Rys. Struktura chemiczna wybranych kannabinoidów poddanych dekarboksylacji.
Kannabinoidy możemy podzielić ze względu na pochodzenie, na wyżej wymienione fitokannabinoidy, produkowane przez ssaki endokannabinoidy oraz kannabinoidy syntetyczne, opracowane na potrzeby lecznicze, przez firmy farmaceutyczne.
Niezależnie od pochodzenia działają one przez układ receptorów kannabinoidowych, do których zaliczamy receptory CB1, CB2, TRPV1 oraz GPR55 [2].
Receptory CB1 i CB2 należą do rodziny receptorów związanych z białkiem G, mechanizm ich działania również związany jest z wpływem na kanały wapniowe i potasowe[3,4]. CB1 lokalizują się w błonach komórkowych presynaptycznych komórek zarówno ośrodkowego jak i obwodowego okładu nerwowego, ich aktywacja skutkuje zahamowaniem uwalniania neuromediatorów m.in. w szklakach noradrenargicznym, dopaminergicznym, serotoninergicznym, jak i również związanych z acetylocholiną, kwasem gammaaminomasłowym oraz hormonami[5]. Ich obecność stwierdzono również m.in. w tkankach jąder, macicy, śródbłonka naczyń, śledzionie, jelitach czy adipocytach oraz na powierzchni limfocytów T[6,7]. Receptory CB2 natomiast umiejscowione są głównie na powierzchniach komórek układu odpornościowego, zwłaszcza limfocytów B, makrofagów i monocytów, komórek NK oraz limfocytów T. Ponadto ekspresje CB2 wykazano w komórkach dendrytycznych, mikrogleju, grasicy oraz śledziony[8]. Pobudzenie tych receptorów wywołuje efekt immunomodulacyjny poprzez wpływ na uwalnianie cytokin (wzrost przeciwzapalnych, zahamowanie prozapalnych)[9]
Receptory waniloidowe TRPV1 (Transient Receptor Potential cation channel subfamily V member 1) są umiejscowione głównie w błonie komórkowej czuciowych neuronów aferentnych, takich jak zwój korzenia grzbietowego, zwój trójdzielny oraz włókna nerwowe [10]. Aktywacja TRPV1 prowadzi do regulacji: przepływu krwi, temperatury ciała oraz odpowiada za uwalnianie insuliny i cytokin [11].
Natomiast sierocy receptor GPR55, również związany z białkiem G, umiejscowiony jest w komórkach mózgu, wątroby, śledzony oraz układu krążenia oraz jelit[12]. Istotną kwestią jest, iż wykazują on największą ekspresje w komórkach nowotworów złośliwych[13]. Jego aktywacja skutkuje modyfikacją liczby i funkcji osteoklastów oraz wzmożoną proliferacją komórek nowotworowych. Domniemuje się ze GPR55 odpowiada również za regulacje napięcia naczyniowego[14].
Do pierwszych i najbardziej znanych endokannabionoidów należą: N-arachidonyloetanoloamid zwany anandamidem (AEA) oraz 2- arachidonyloglicerol (2-AG).
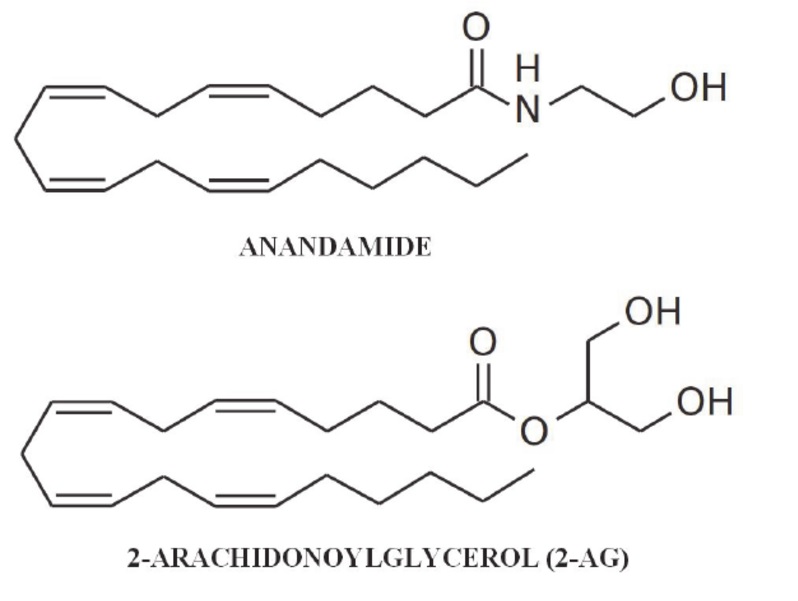
Rys. Budowa chemiczna AEA oraz 2-AG
Anandamid produkowany jest z fosfolipidów błony komórkowej, najwyższe jego stężenia odnotowuje się w obrębie tkanki mózgowej. Znany jest jako agonista receptorów kannabinoidowych, głównie CB1 ale również, w mniejszym stopniu, CB2 i TRPV1. Aktywacja CB1, hamując aktywność cyklazy adenylowej działa antyproliferacyjnie, podwyższa tworzenie aktywnych form tlenu i aktywacje kaspazy-3 czego skutkiem jest nasilenie apoptozy komórek nowotworowych[15] wpływa również na wzrost ceramidów i aktywacje kaskady kinaz Raf1/ERK [16] oraz kinaz JNK/p38[17] Aktywacja CB2 powoduje również wzrost stężenia ceramidów czego skutkiem, poprzez ekspresje białka p28 i czynnika transkrypcyjnego 4, jest działanie apoptyczne [18]
Pobudzając receptor TRPV1, AEA przyczynia się do nasilenia stresu oksydacyjnego i aktywacji kalpain, co także prowadzi do apoptozy[19]
2-arachidonyloglicerol jest również głównie zlokalizowany w tkankach mózgowych, przy czym jego stężenie jest blisko 800 razy większe niż AEA[20], łączy się z receptorami CB1 i CB2 łatwiej niż anandamid[21]. Aktywacja CB2 powoduje działania antyoksydacyjne i przeciwzapalnie poprzez zmniejszanie produkcji cytokiny Il-17[22], natomiast przyłączenie do CB1 skutkuje zahamowaniem wzrostu i proliferacji komórek nowotworowych[23]. Ponadto 2-AG bierze odział w aktywacji szlaków transdukcji sygnałów w układach hormonalnym i odpornościowym, uczestniczy w wytwarzaniu tlenku azotu oraz PGE2 przez indukcję NOS i COX-2 [24]
Wielokierunkowe działanie czy to fito- czy endokannabnoidów, jak u również tych syntetycznego pochodzenia(preparaty Nabilon, Dronabilol), uwarunkowane są obecnością licznych receptorów, ich szerokim rozpowszechnieniem w całym ustroju oraz złożonymi mechanizmami działania.
Bibliografia:
[1]Fischedick, J. T., Hazekamp, A., Erkelens, T., Choi, Y. H., and Verpoorte, R. (2010). Metabolic fingerprinting of Cannabis sativa L., cannabinoids and terpenoids for chemotaxonomic and drug standardization purposes. Phytochemistry 71, 2058–2073. doi: 10.1016/j.phytochem.2010.10.001
[2]Alexander S.P.: Therapeutic potential of cannabis related drugs. Prog. Neuropsychopharmacol. Biol. Psychiatry, 2016; 64: 157 166
[3]Glass, M., & Northup, J. K. (1999). Agonist Selective Regulation of G Proteins by Cannabinoid CB1and CB2Receptors. Molecular Pharmacology, 56(6), 1362–1369. doi:10.1124/mol.56.6.1362
[4]Caulfield MP and Brown DA (1992) Cannabinoid receptor agonists inhibit Ca21
current in NG108–15 neuroblastoma cells via a pertussis toxin sensitive mechanism. Br J Pharmacol 106:231–232.
[5] Pacher P., Bátkai S., Kunos G.: The endocannabinoid system as an emerging target of pharmacotherapy. Pharmacol. Rev., 2006; 8: 389-462
[6]8. Mackie K. Distribution of cannabinoid receptors in the central and peripheral nervous system. Handb Exp Pharmacol. 2005;168:299–325.
[7]Borner, C., Bedini, A., Hollt, V., Kraus, J., 2008. Analysis of promoter regions regulating basal and interleukin-4-inducible expression of the human CB1 receptor gene in T lymphocytes. Mol. Pharmacol. 73, 1013–1019.
[8]Galiegue, S., Mary, S., Marchand, J., Dussossoy, D., Carriere, D., Carayon, P., Bouaboula, M., Shire, D., Le Fur, G., Casellas, P., 1995. Expression of central and peripheral cannabinoid receptors in human immune tissues and leukocyte subpopulations. Eur. J. Biochem. 232, 54–61
[9] Pacher P., Bátkai S., Kunos G.: The endocannabinoid system as an emerging target of pharmacotherapy. Pharmacol. Rev., 2006; 8: 389-462
[10]Kim Y.H., Back S.K., Davies A.J., Jeong H., Jo H.J., Chung G., Na H.S., Bae Y.C., Kim S.J., Kim J.S., Jung S.J., Oh S.B..: TRPV1 in GABAergic interneurons mediates neuropathic mechanical allodynia and disinhibition of the nociceptive circuitry in the spinal cord. Neuron, 2012; 74: 640-647
[11]Premkumar L.S., Abooj M.: TRP channels and analgesia. Life Sci., 2013; 92: 415-424
[12]Li K., Fichna J., Schicho R., Saur D., Bashashati M., Mackie K., Li Y., Zimmer A., Göke B., Sharkey K.A., Storr M.: A role for O-1602 and G protein-coupled receptor GPR55 in the control of colonic motility in mice. Neuropharmacology, 2013; 71: 255-263
[13]Andradas C., Caffarel M.M., Pérez-Gómez E., Salazar M., Lorente M., Velasco G., Guzmán M., Sánchez C.: The orphan G protein-coupled Piśmiennictwo receptor GPR55 promotes
[14]Ryberg, E. , Larsson, N. , Sjögren, S. , Hjorth, S. , Hermansson, N. , Leonova, J. , Elebring, T. , Nilsson, K. , Drmota, T. and Greasley, P. J. (2007), The orphan receptor GPR55 is a novel cannabinoid receptor. British Journal of Pharmacology, 152: 1092-1101. doi:10.1038/sj.bjp.0707460
[15]Cianchi F., Papucci L., Schiavone N., Lulli M., Magnelli L., Vinci M.C., Messerini L., Manera C., Ronconi E., Romagnani P., Donnini M., Perigli G., Trallori G., Tanganelli E., Capaccioli S., Masini E.: Cannabinoid receptor activation induces apoptosis through tumor necrosis factor α-mediated ceramide de novo synthesis in colon cancer cells. Clin. Cancer Res., 2008; 14: 7691-7700
[16]Andre C. M., Larondelle Y., Evers D. (2010). Dietary antioxidants and oxidative stress from a human and plant perspective: a review. Curr. Nutr. Food Sci. 6 2–12. 10.2174/157340110790909563
[17]Rueda D., Galve-Roperh I., Haro A., Guzman M.: The CB1 cannabinoid receptor is coupled to the activation of c-Jun N-terminal kinase. Mol. Pharmacol., 2000; 58: 814-820
[18]Carracedo A., Gironella M., Lorente M., Garcia S., Guzmán M.,Velasco G., Iovanna J.L.: Cannabinoids induce apoptosis of pancreatic tumor cells via endoplasmic reticulum stress-related genes. Cancer Res., 2006; 66: 6748-6755
[19]Jacobsson S.O., Wallin T., Fowler C.J.: Inhibition of rat C6 glioma cell proliferation by endogenous and synthetic cannabinoids. Relative involvement of cannabinoid and vanilloid receptors. J. Pharmacol. Exp. Ther., 2001; 299: 951-959
[20]Bradshaw H.B., Rimmerman N., Krey J.F., Walker J.M.: Sex and hormonal cycle differences in rat brain levels of pain-related cannabimimetic lipid mediators. Am. J. Physiol. Regul. Integr. Comp.
Physiol., 2006; 291: R349-R358
[21]Steffens M., Feuerstein T.J., Van Velthoven V., Schnierle P.,Knörle R.: Quantitative measurement of depolarization-induced anandamide release in human and rat neocortex. Naunyn-Schmiedebergs
Arch. Pharmacol., 2003; 368: 432-436
[22]Sugiura T., Kishimoto S., Oka S., Gokoh M.: Biochemistry, pharmacology and physiology of 2-arachidonoylglycerol, an endogenous cannabinoid receptor ligand. Prog. Lipid. Res., 2006; 45: 405-446
[23]Liao Y.S., Wu J., Wang P., Zhang H.: Anandamide inhibits the growth of colorectal cancer cells through CB1 and lipid rafts. Zhonghua Zhong Liu Za Zhi, 2011; 33: 256-259
[24]Vannacci A., Giannini L., Passani M.B., Di Felice A., Pierpaoli S., Zagli G., Fantappie O., Mazzanti R., Masini E., Mannaioni P.F.: The endocannabinoid 2-arachidonylglycerol decreases the immunological activation of guinea pig mast cells: involvement of nitric oxide and eicosanoids. J. Pharmacol. Exp. Ther., 2004; 311: 256-264











